自1932年以来,人们提出了许许多多核结构模型。有(1)液滴模型——把原子核看做一个带电的液滴,原子核的半径随着核子数增多而增大;(2)费米气体模型——把核子看做几乎没有相互作用的气体分子,由于核子是费米子,原子核就可视为费米气体;(3)核的壳层模型。下面简要介绍原子核的壳层模型。
原子的壳层结构是解释元素周期性的基础,元素的化学、物理性质按一定的周期重复出现,原子序数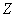 等于2,10,18,36,54,…时,元素最稳定,这些本来使人感到迷惑的数(称之为幻数),从壳层结构中得到了圆满地解释。 等于2,10,18,36,54,…时,元素最稳定,这些本来使人感到迷惑的数(称之为幻数),从壳层结构中得到了圆满地解释。
20世纪30年代以后,有关原子核的实验事实不断地显示,自然界存在一系列幻数核,即当质子数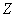 或中子数 或中子数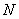 等于下列数之一时: 等于下列数之一时:
2,8,20,28,50,82,126
原子核特别稳定。虽然核的幻数不同于原子,但是,稳定性却是共同的。有人就自然地想到了壳层结构。但是,原子核存在壳层结构的这一想法很快就被否定了,主要有如下原因:
(1)当时对原子核的了解很不够,这一想法缺乏一定的物理基础。在原子内部,存在一个占原子总质量绝大部分的固定的原子核,电子在原子核提供的中心库仑场中运动。因此,当时人们把存在壳层结构与存在一个中心体相联系。对于原子核,核子都是以平等的地位在核内运动,并不存在一个中心体。同时人们又缺乏对泡利原理的深刻理解,因此人们怀疑原子核存在壳层结构这一想法是否有物理基础。
(2)解释不了幻数。在原子核费米气体模型获得一定成功的启示下,人们相信原子核内部的核子相互作用平均的结果,将提供一个自洽场,核子将在此自洽场中作单粒子运动。人们假设了各种自洽场形式,通过解薛定谔方程,希望能得出原子核的壳层结构,解释幻数。但是不论取何种自洽场形式,如方位势阱、谐振子势等,都无法得出符合原子核幻数的壳层结构来。
(3)当时与壳层模型观念完全不同的原子核液滴模型获得很大的成功。液滴模型不考虑核子在核内的总体运动状态,而是考虑原子核的总体运动形态。当时,用液滴模型推导出了结合能的半经验公式,与实验符合较好;在1936年玻尔把液滴模型成功地用于核反应截面计算,在1939年他和惠勒又用液滴模型解释了核的裂变机制。
这样,一方面当时人们认为壳层模型缺乏物理基础,做出的一定努力又没获得成功;另一方面,在观念上相反的液滴模型当时又获得很大成功,人们普遍地否定了原子核的壳层模型。
然而,支持幻数核存在的实验事实不断地在增加,大量的实验事实迫使人们不得不重新认真地考虑原子核的壳层模型。1949年,迈耶和简森整理和分析了大量的实验事实,确认原子核中壳层结构是客观存在的。在理论上,除了原先已考虑的自洽场外,还提出加上自旋-轨道耦合势。他们终于用壳层模型成功地解释了幻数,由于这一工作,他们获得1963年度诺贝尔物理学奖。 |