热力学第一定律确定了系统在状态变化过程中被传递的热量、功和内能之间的相互关系,不论是气体、液体或固体的系统都适用。本节讨论在理想气体的几种平衡过程中,热力学第一定律的应用。
1.等体过程 气体的摩尔定容热容 |
而作为 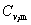 的定义式,可将上式改写成

由于在等体过程中 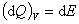 ,所以 应该注意,上式是计算任意过程中理想气体内能变化的 通用关系式,不仅仅适用于等体过程。将理想气体内能表达式求微分可得 所以
理想气体的摩尔等体热容是一个只与分子的自由度有关的量。它与气体的温度无关。 |
2.等压过程 气体的摩尔定压热容 |
线下的面积表示,因此在此过程中 ,又由想气体状态方程 ,又由想气体状态方程
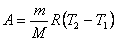
根据热力学第一定律,系统吸收的热量为
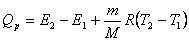
气体的摩尔定压热容 考虑在等压过程中的一微过程,热力学第一定律表示为
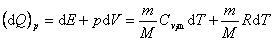
由摩尔热容的定义,气体的摩尔定压热容为
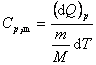 |
因此, 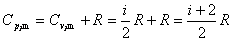 |
3.等温过程 |
在等温过程中,由于温度不变,因此有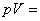 常量,系统对外做功 常量,系统对外做功
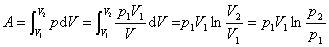
由理想气体状态方程,上式可表示为
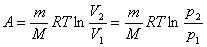
由于等温过程中系统内能不变,由热力学第一定律
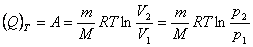 |
|
|
|